生物大分子是生物学中的重要概念,在我国的高中生物教材中就已出现,是学习物质代谢、能量代谢和信息传递等生命活动的基础。然而,对生物大分子的准确定义以及其所包含的物质种类不同教材却说法不一,给教师教学和学生学习带来一定的困扰,有必要进行辨析和考证。已有文献提及过此问题,但似乎没有给出准确的定义和标准,多是成分罗列,也没有提供详细的文献依据和物质种类,更没有对概念的准确把握,故有必要再进行深入讨论。高中生物教材对生物大分子的不同定义现行高中生物主要教材对生物大分子的说法和定义不一,上海项目熙宁生物。如人教版教材中说“多糖、蛋白质、核酸等都是生物大分子”;而北师大版教材中则说“糖类、脂质、蛋白质、核酸是组成生物体重要的生物大分子”;浙科版教材认为在所有的生物体内,存在3类生物大分子,糖类、蛋白质和核酸,上海项目熙宁生物,有时为了方便把脂质也归为生物大分子苏教版教材却提到:“糖类、脂质和蛋白质等都是细胞中的生物大分子”。从以上四种教材对生物大分子的提法来看,只有“蛋白质”在所有定义中都出现,而其他物质却不统一。其中的焦点则是“糖类”和“脂质”。众所周知,糖类包含单糖,上海项目熙宁生物、寡糖和多糖。 中和抗体检测方法中具备很好的适应性,熙宁生物具有自主知识产权。上海项目熙宁生物
如果预期的Cmax不高于ULOQ,那么所有样本分析均可在单一稀释倍数下进行;这意味着可能不需要评估稀释线性度,因为同一微孔板上QCs的稀释足以证明这一点。稳定性监管级:对于需要监管级验证的方法,在研究前,评估生物基质中待测物的稳定性是至关重要的。稳定性评估应涵盖,在研究期间,所有预期的样本储存条件,包括:临床或动物实验期间、运输期间、任何中间地点和PK生物分析实验室。长期稳定性必须至少涵盖从样本采集到生物分析完成之前,任何研究样本在相关储存条件下的储存时间。此外,还必须评估预期的样本处理过程中的稳定性,包括冷冻-解冻稳定性、工作台稳定性(或样本处理条件),以及,如果在分析前进行样本处理,处理后样本的稳定性。已建立的稳定性应达到或超过研究样本的实际处理时间和条件。至少应该在HQC和LQC水平上评估样本的稳定性,并与新制备的STD和QCs进行比较。如果稳定性样本的分析数值的偏差在15%或20%范围内,则满足稳定性的接受要求。科学级:经科学级验证的分析方法的生命周期通常很短,而且参照(比)标准物本身的稳定性往往没有很好地建立起来。参照(比)标准物的稳定性数据的缺乏也意味着没有必要研究待测物在生物基质中的长期稳定性。上海项目熙宁生物精翰生物流式项目团队,多个项目经验,已与多家临床研究中心(医院)合作,提供全血分离PBMC整套解决方案。
特异性和交叉反应性对ELISA方法的选择性和基质效应有很大影响。如果使用高亲和力抗体作为捕获试剂,抗体/目标分析物的复合物就能够在含有多种蛋白质的“混合物”样品中有效地形成;基质效应会随之降低,而方法的选择性**终会得到提升。。PK测试方法测试试剂的可及性可能因药物开发的不同阶段而异。在早期阶段,可能无法得到MAbs或PAbs,故常常选择重组生产的配体(即生物药的靶点)作为关键试剂来测定游离的蛋白生物药(therapeuticprotein,TP)的浓度。在早期临床前研究中,针对IgGFc部分的通用抗体可用于单克隆抗体药物,尽管*能测定总浓度(结合靶标后的TP+游离的TPf)。表1.用于PK、生物标志物和免疫原性测试的常用试剂和优先测试格式生物标志物的定量分析方法各种体外诊断试剂盒在商业上可用于药物的早期发现阶段。也可从不同的供应商获得各种重组蛋白和抗生物标记物蛋白的抗体。虽然生物标记物的定量分析方法与PK方法相似,但这二者之间存在明显差别。与PK方法类似,生物标志物的定量分析方法可用于测定目标基质中生物标志物蛋白的游离浓度或总浓度。夹心式测试格式是主要选择,通常用于测定生物标志物蛋白的游离或总浓度。虽然当一个生物药具有***作用时。
则样本的测定结果是可以接受的。如果2/3的测试样本(67%)符合样品接受标准,则整个评估合格。如果评估失败,必须进行调查以确定失败原因,并应采取适当措施,尽量减少不准确的结果。此外,还应该使用ISR样本评估方法的平行性。平行性在概念上类似于稀释线性,但使用实际研究样本进行连续稀释;单个样本之间的个别基质成分的差异可能会干扰测定结果。虽然FDA指南草案规定,“稀释后研究样本的平行性应使用稀释后的校准品进行评估,以检测基质效应”,但没有就接受标准提出指导。EMA指南对评估样本平行性的期望提供了更多信息:"应使用空白基质稀释高浓度的研究样本(**好接近Cmax)到至少三个浓度。稀释系列中的样本之间的精密度不应超过30%。因此,应选择在Cmax附近的研究样本并连续稀释,使得至少三个稀释浓度在方法的ROQ内。如果稀释结果回算后浓度的%CV≤30%,则样品符合验收要求。如果评估失败,必须制定一个计划,说明如何报告稀释样本的测定浓度。科学级:对于经科学级验证的方法,常规的话,不会在研究中对ISR和平行性做一步的验证/评估。如果在研究中样本分析的过程中观察到样本稀释的非平行性,则可以按照与监管级验证相同的设计和接受标准来评估平行性。熙宁生物主要检测内容包含药代动力学(PK),药效动力学(PD),抗药抗体(ADA),中和抗体(NAb)。
应该评估的方法参数,接受标准和建议的文档记录将在下面与其他两个验证级别进行比较。表1总结了使用研究级验证工作流程进行研究前方法效能评估的标准,并将这些标准与监管级验证和科学级验证工作流程进行比较。表2总结了经研究级验证方法用于研究样本分析和文档记录的接受标准,并与使用经监管/科学级验证的方法相比较。3.分析方法参数和验收标准在以下的方法参数和接受标准的介绍中,将*参考**新的美国FDA草案和**终的EMA指南文件,因为这些是**常用的准则和指南文件,其他机构提出指南的往往与这二两者之一是一致的。参照(比)标准物监管级:监管指南要求将已知数量的表征过的参照(比)标准(即生物药)加入到样本基质中,以便构建一条校准曲线;之后,使用该标准曲线确定质量控制样品(QCs)和未知研究样本中生物药的浓度。对于经监管验证的方法,必须使用具有充分表征和文档记录(即,分析证书/CoA)的药物原液(drugstock);因为生物药原液的质量**终可能影响分析结果和研究数据。一般而言,生物药并非均一结构的,其药效和免疫原性可能会有所不同;因此还需要强调的是,用于制备研究中生物分析的标准曲线的校准品(standards。从稳转细胞株构建,方法开发优化,到方法验证和样本分析,精翰提供一体化全流程细胞学生物分析方法服务。山东熙宁生物服务电话
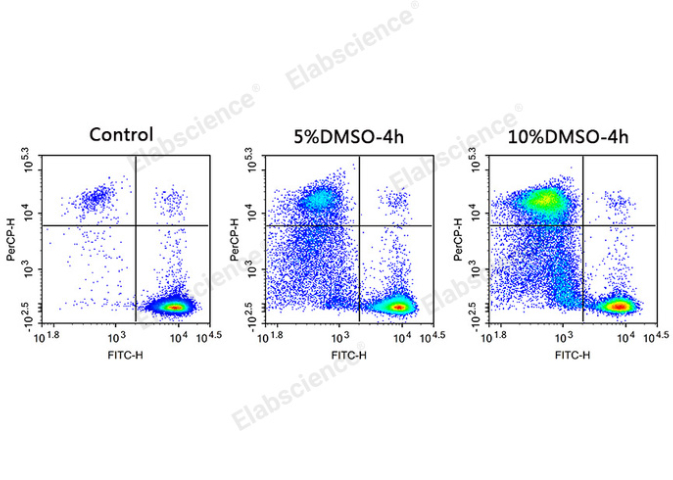
熙宁细胞平台构建的细胞系是以中和抗体检测服务为目的进行载体设计和单克隆筛选评价。上海项目熙宁生物
建议使用这两个额外的级别,即科学验证和研究验证。这些级别对应于生物分析中通常所说的"较少验证","部分验证","认证qualification","发现方法discoverymethod"和"研究方法researchmethod",等。在药物开发的早期阶段(即,在药物发现阶段与早期临床前/早期临床阶段)与其晚期相比,所需要回答的关键问题和对数据质量的期望存在明显差异,这都支持另外两个级别的创建。在本文中,对每一个验证级别,所应该评估的参数和相应的接受标准都进行了明确的区分。第1级:监管级验证用于支持下述研究的生物分析方法,GLP临床前研究、关键临床研究(即II期和III期关键研究,或称为监管注册研究),以及用于决定给药剂量的决策或药品标签声明的其他临床研究,需要进行监管验证。这包括在现行法规,指南性文件中确立的研究前和研究中方法验证的全部内容,以及在若干白皮书中对PK方法验证和实施中应该采用的**佳实践的进一步详细描述。经监管验证的方法,需要能够减轻基质成分的干扰,并在分析方法的生命周期或药物开发计划的持续期间提供足够的稳健性(robustness)。因此,必须对所有的方法参数,样品采集和储存条件进行严格的评估,并且必须采用严格的接受标准进行研究前方法验证。上海项目熙宁生物
宁波熙宁检测技术有限公司主要经营范围是医药健康,拥有一支专业技术团队和良好的市场口碑。公司业务分为生物分析,临床检测,生物药检测,免疫原性检测等,目前不断进行创新和服务改进,为客户提供良好的产品和服务。公司注重以质量为中心,以服务为理念,秉持诚信为本的理念,打造医药健康良好品牌。宁波熙宁检测技术立足于全国市场,依托强大的研发实力,融合前沿的技术理念,飞快响应客户的变化需求。
文章来源地址: http://yyby.m.chanpin818.com/swzp/ktky/deta_7345822.html
免责声明: 本页面所展现的信息及其他相关推荐信息,均来源于其对应的用户,本网对此不承担任何保证责任。如涉及作品内容、 版权和其他问题,请及时与本网联系,我们将核实后进行删除,本网站对此声明具有最终解释权。




 [VIP第1年] 指数:3
[VIP第1年] 指数:3